- Определение
- Химический состав солей
- Строение молекул солей
- Взаимодействие солей
- Регулирование растворимости солей
- Применение солей
- Классификация солей по происхождению
- Классификация солей по типу катиона
- Классификация солей по типу аниона
- Классификация солей по типу соединительной связи
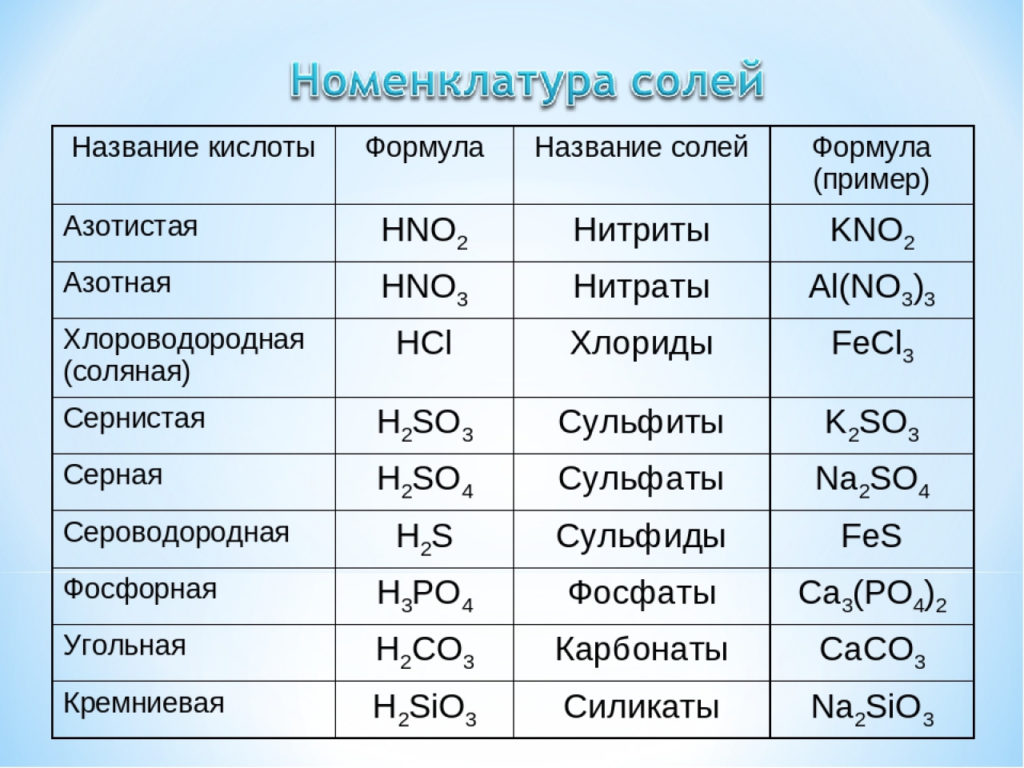
- Формулы и примеры солей
- Правила записи формул солей
- Примеры солей из различных классов
- Формулы и примеры солей
Определение
Соли — это класс химических соединений, образующихся в результате взаимодействия кислот и оснований. В общем виде реакцию образования солей можно записать следующим образом:
Кислота + Основание → Соль + Вода
Химический состав солей
Соли состоят из катионов (положительно заряженных ионов) и анионов (отрицательно заряженных ионов). Катионы обычно представляют собой металлические элементы, в то время как анионы могут быть не только неметаллическими элементами, но и радикалами. Вот некоторые общие типы солей:
- Оксидные соли: NaCl (хлорид натрия), KBr (бромид калия)
- Сульфаты: BaSO4 (сульфат бария), MgSO4 (сульфат магния)
- Нитраты: KNO3 (нитрат калия), NaNO3 (нитрат натрия)
- Фосфаты: Ca3(PO4)2 (фосфат кальция), (NH4)3PO4 (фосфат аммония)
Строение молекул солей
Соли образуют кристаллические структуры, которые определяются расположением катионов и анионов в пространстве. Структура соли зависит от вида и размера ионов и их заряда. Вот некоторые типичные структуры солей:
- Кубическая решетка: NaCl (хлорид натрия), KCl (хлорид калия)
- Гексагональная решетка: MgSO4 (сульфат магния), ZnO (оксид цинка)
- Тетрагональная решетка: KNO3 (нитрат калия), BaTiO3 (титанат бария)
Взаимодействие солей
Соли могут взаимодействовать с водой с образованием различных растворов. Существуют три основных типа такого взаимодействия:
- Растворение: многие соли (например, NaCl, KNO3) хорошо растворяются в воде, образуя однородные растворы.
- Гидратация: некоторые соли (например, CuSO4·5H2O, MgSO4·7H2O) образуют гидраты, связывая водные молекулы с ионами соли.
- Нерастворимые соли: некоторые соли (например, BaSO4, PbCl2) практически не растворяются в воде и осаждаются на дне сосуда в виде твердого осадка.
Регулирование растворимости солей
Растворимость солей в воде может быть увеличена или уменьшена путем изменения температуры и давления. Например, растворимость многих солей увеличивается с повышением температуры, в то время как растворимость газообразных солей уменьшается.
Применение солей
Соли имеют многочисленные применения в различных отраслях, включая промышленность, медицину и пищевые процессы. Некоторые из применений солей:
- Хлорид натрия (поваренная соль) используется для приготовления пищи и консервации продуктов.
- Сульфат магния (известный как ангидрит или горькая соль) применяется в медицине для лечения недостатка магния и как слабительное средство.
- Нитрат калия используется в сельском хозяйстве как удобрение и в производстве пиротехнических изделий.
- Фосфат кальция применяется в зубных пастах для укрепления зубной эмали и в качестве добавки в пищевой промышленности.
Соли являются важными химическими соединениями с разнообразными свойствами и применениями. Их химический состав, структура молекул и взаимодействие с водой определяют их роль в природе и в повседневной жизни человека.
Классификация солей по происхождению
Соли можно классифицировать по их происхождению на несколько основных групп:
- Минеральные соли: эти соли образуются естественным образом в земной коре или из водоемов и морей. Примеры таких солей включают:
- Хлорид натрия (галит) — образуется при испарении морской воды.
- Гипс (CaSO4·2H2O) — минерал, образующийся при испарении морских водоемов.
- Калийные соли, такие как силвинит (KCl·NaCl) — встречаются в калийных месторождениях.
- Органические соли: эти соли образуются в результате жизнедеятельности организмов. Некоторые примеры органических солей:
- Оксалат кальция (CaC2O4) — встречается в растениях, таких как щавель и ревень.
- Фосфаты, такие как гидроксиапатит (Ca5(PO4)3OH) — главный компонент костной ткани и зубной эмали.
- Синтетические соли: эти соли получают в результате химических реакций, проводимых в лабораторных или промышленных условиях. Примеры синтетических солей:
- Ацетат натрия (CH3COONa) — соль уксусной кислоты и натрия, получаемая при нейтрализации уксусной кислоты гидроксидом натрия.
- Нитрат аммония (NH4NO3) — получается в результате реакции аммиака с азотной кислотой и широко используется в качестве удобрения.
Классификация солей по происхождению позволяет лучше понять их свойства, источники и применение в различных областях жизнедеятельности человека.
Классификация солей по типу катиона
Соли могут быть классифицированы на основе типа катиона, который представляет собой положительно заряженный ион в составе соли. Вот некоторые основные группы солей на основе типа катиона:
- Соли щелочных металлов (1-я группа периодической системы элементов):
- Хлорид натрия (NaCl) — катион Na+.
- Нитрат калия (KNO3) — катион K+.
- Соли щелочноземельных металлов (2-я группа периодической системы элементов):
- Сульфат магния (MgSO4) — катион Mg2+.
- Фосфат кальция (Ca3(PO4)2) — катион Ca2+.
- Соли переходных металлов (группы 3-12 периодической системы элементов):
- Сульфат меди (CuSO4) — катион Cu2+.
- Хлорид железа (FeCl3) — катион Fe3+.
- Соли побочных подгрупп (группы 13-17 периодической системы элементов):
- Хлорид алюминия (AlCl3) — катион Al3+.
- Бромид свинца (PbBr2) — катион Pb2+.
- Соли актиноидов и лантаноидов (ф элементы периодической системы элементов):
- Нитрат урана (UO2(NO3)2) — катион UO2^2+.
- Хлорид церия (CeCl3) — катион Ce3+.
- Соли аммония (аммиачные соли):
- Хлорид аммония (NH4Cl) — катион NH4+.
- Сульфат аммония ((NH4)2SO4) — катион NH4+.
Классификация солей по типу катиона позволяет лучше понимать их свойства и использование в различных химических реакциях и промышленных процессах.
Классификация солей по типу аниона
Соли также могут быть классифицированы на основе типа аниона, который представляет собой отрицательно заряженный ион в составе соли. Вот некоторые основные группы солей на основе типа аниона:
- Хлориды (анион Cl⁻):
- Хлорид натрия (NaCl) — кухонная соль, используется в пищевой промышленности и быту.
- Хлорид аммония (NH4Cl) — применяется в производстве батарей и холодильных установках.
- Сульфаты (анион SO₄²⁻):
- Сульфат магния (MgSO₄) — используется в медицине как слабительное средство и для лечения недостатка магния.
- Сульфат меди (CuSO₄) — применяется в сельском хозяйстве для защиты растений от вредителей и болезней.
- Нитраты (анион NO₃⁻):
- Нитрат калия (KNO₃) — используется в сельском хозяйстве в качестве удобрения и в пиротехнике.
- Нитрат аммония (NH₄NO₃) — широко применяется в качестве азотного удобрения.
- Карбонаты (анион CO₃²⁻):
- Карбонат кальция (CaCO₃) — известняк, применяется в строительстве и для производства цемента.
- Карбонат натрия (Na₂CO₃) — сода, используется в стекольной и мыловаренной промышленности.
- Фосфаты (анион PO₄³⁻):
- Фосфат кальция (Ca₃(PO₄)₂) — применяется в зубных пастах для укрепления зубной эмали и в пищевой промышленности.
- Фосфат аммония ((NH₄)₃PO₄) — используется как источник фосфора и азота в удобрениях.
Классификация солей по типу соединительной связи
Соли могут быть классифицированы на основе типа соединительной связи между катионами и анионами. Вот основные типы солей в зависимости от характера связи:
- Ионные соли: в этих соединениях преобладают ионные связи, образующиеся между катионами и анионами благодаря электростатическому притяжению. Ионные соли обычно обладают высокими температурами плавления и хорошей растворимостью в воде. Примеры ионных солей:
- Хлорид натрия (NaCl)
- Сульфат магния (MgSO4)
- Ковалентные соли: эти соли содержат ковалентные связи, образующиеся за счет обмена электронами между атомами. Ковалентные соли обычно имеют более низкие температуры плавления и слабую растворимость в воде по сравнению с ионными солями. Примеры ковалентных солей:
- Сульфид молибдена (MoS2)
- Теллурид кадмия (CdTe)
- Смешанные соли: в этих солях присутствуют как ионные, так и ковалентные связи. Эти соли обладают промежуточными свойствами между ионными и ковалентными солями и могут иметь разнообразные химические и физические свойства. Примеры смешанных солей:
- Титанат бария (BaTiO3)
- Силикаты, такие как фельдспаты (KAlSi3O8, NaAlSi3O8)
Классификация солей по типу соединительной связи позволяет лучше понять их химические и физические свойства, а также применение в различных областях науки и техники.
Формулы и примеры солей
Соли представляют собой химические соединения, образующиеся в результате взаимодействия кислот и оснований. В данной статье рассмотрим правила записи формул солей, примеры солей из различных классов и химические свойства и применение некоторых из них.
Правила записи формул солей
- Сначала записывается катион (положительно заряженный ион), затем анион (отрицательно заряженный ион).
- Количество атомов каждого элемента указывается справа от его символа как индекс.
- Заряды ионов обычно не указываются в формуле соли, но могут быть учтены в скобках или в уравнении реакции.
Примеры солей из различных классов
- Соли щелочных металлов:
- Хлорид натрия (NaCl) — кухонная соль
- Карбонат натрия (Na2CO3) — сода
- Соли щелочноземельных металлов:
- Сульфат магния (MgSO4) — горькая соль или эпсомит
- Карбонат кальция (CaCO3) — известняк
- Соли переходных металлов:
- Сульфат меди (CuSO4) — голубой купорос
- Хлорид железа (FeCl3) — феррихлорид
- Соли побочных подгрупп:
- Хлорид алюминия (AlCl3)
- Нитрат свинца (Pb(NO3)2)
- Соли актиноидов и лантаноидов:
- Нитрат урана (UO2(NO3)2)
- Хлорид церия (CeCl3)
- Соли аммония (аммиачные соли):
- Хлорид аммония (NH4Cl)
- Сульфат аммония ((NH4)2SO4)
Формулы и примеры солей
Соли — это класс химических соединений, образованных катионами (положительно заряженными ионами) и анионами (отрицательно заряженными ионами). В этой статье рассмотрим формулы и примеры некоторых солей, а также их химические свойства и применение.
Хлорид натрия (NaCl)
Химические свойства:
- Растворим в воде, образуя ионы Na+ и Cl-.
- Термически устойчив и разлагается при температуре выше 800°C.
Применение:
- В качестве поваренной соли для приготовления пищи.
- В производстве хлора и щелочей.
Сульфат меди (CuSO4)
Химические свойства:
- Растворим в воде, образуя ионы Cu2+ и SO4^2-.
- Образует гидрат (CuSO4·5H2O), известный как синька или витриол.
Применение:
- В качестве фунгицида для борьбы с грибковыми заболеваниями растений.
- В химической промышленности для получения других соединений меди.
Карбонат кальция (CaCO3)
Химические свойства:
- Слаборастворим в воде, образуя ионы Ca2+ и CO3^2-.
- Разлагается при нагревании, выделяя углекислый газ (CO2) и образуя оксид кальция (CaO).
Применение:
- В качестве антацида для нейтрализации избыточной кислоты в желудке.
- В строительстве для получения цемента и извести.