- Теоретические основы
- Что такое соль
- Как происходит гидролиз солей
- Какие факторы влияют на гидролиз солей
- Классификация гидролиза солей
- Кислотный гидролиз
- Основной гидролиз
- Смешанный гидролиз
- Примеры гидролиза солей
- Гидролиз солей кислых металлов
- Гидролиз солей щелочных металлов
- Гидролиз солей амфотерных металлов
- Практическое применение гидролиза солей
- В производстве
- В аналитической химии
- В медицине
Теоретические основы
Что такое соль
Соль – это химическое соединение, образованное из катиона (положительно заряженного иона) и аниона (отрицательно заряженного иона) путем ионного взаимодействия. Соли можно классифицировать по следующим категориям:
- Неорганические соли: хлорид натрия (NaCl), сульфат магния (MgSO4), нитрат калия (KNO3).
- Органические соли: ацетат натрия (CH3COONa), цитрат калия (C6H5K3O7).
Как происходит гидролиз солей
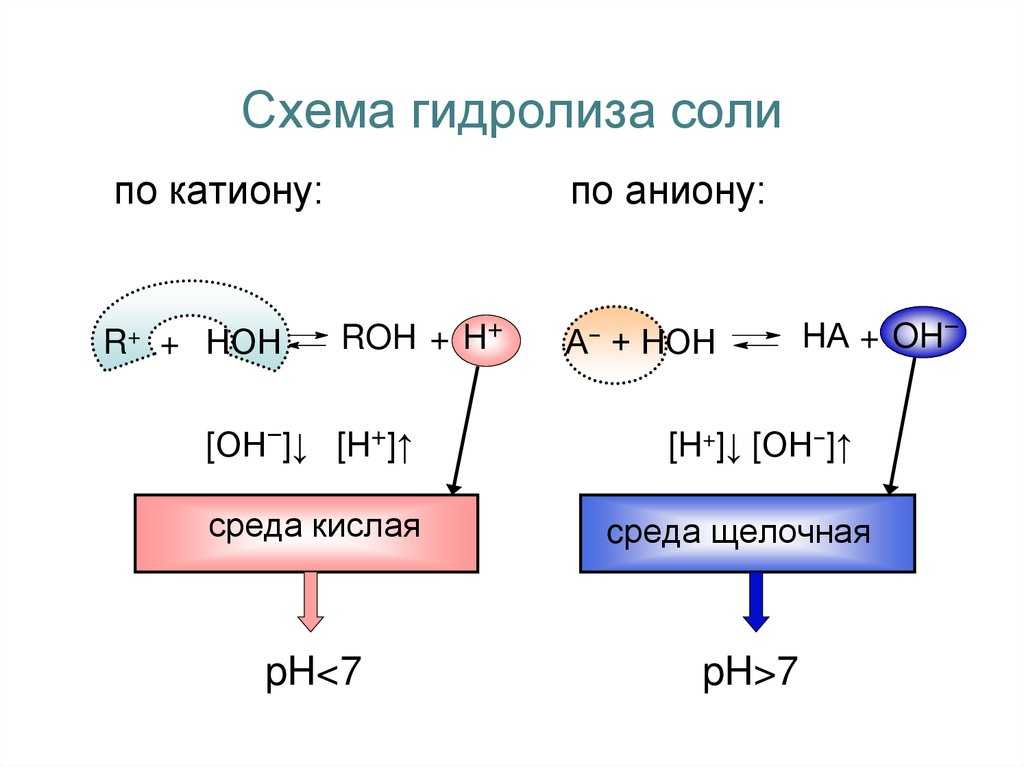
Гидролиз солей – это процесс разложения соли на ионы в водной среде, в результате чего образуются кислоты и основания. Рассмотрим гидролиз хлорида аммония (NH4Cl):
NH4Cl + H2O → NH4+ + Cl- → NH3 + H3O+
В этом примере, NH4Cl гидролизуется на аммиак (NH3) и гидроний-ион (H3O+). Гидролиз солей можно поделить на два типа:
- Полный гидролиз: исходная соль полностью превращается в кислоту и основание (например, гидролиз солей слабых кислот и слабых оснований).
- Частичный гидролиз: только часть исходной соли превращается в кислоту и основание (например, гидролиз солей сильных кислот и сильных оснований).
Какие факторы влияют на гидролиз солей
- Сила кислоты и основания: степень гидролиза зависит от силы образующихся кислот и оснований. Сильные кислоты и основания слабо гидролизуются, тогда как слабые кислоты и основания гидролизуются сильнее.
- Концентрация соли: чем выше концентрация соли в растворе, тем больше вероятность гидролиза.
- Температура: повышение температуры увеличивает скорость гидролиза солей.
- Катализаторы: некоторые вещества, такие как амфотерные гидроксиды, могут ускорять гидролиз солей, выступая в роли катализаторов.
- Ионный эффект: присутствие других ионов в растворе может повлиять на процесс гидролиза солей, увеличивая или уменьшая степень гидролиза.
Важно знать, что гидролиз солей играет значительную роль в химии и окружающей среде. Например, гидролиз солей используется для получения оснований и кислот, очистки воды и регулирования кислотности почвы. Знание факторов, влияющих на гидролиз солей, позволяет контролировать этот процесс для удовлетворения различных потребностей в промышленности и науке.
Классификация гидролиза солей
Гидролиз солей – это процесс разложения соли на ионы в водной среде, в результате чего образуются кислоты и основания. Гидролиз солей может быть классифицирован следующим образом:
Кислотный гидролиз
Кислотный гидролиз происходит, когда соли слабых оснований и сильных кислот гидролизуются с образованием кислот. Примером такой соли является хлорид аммония (NH4Cl):
NH4Cl + H2O → NH4+ + Cl- → NH3 + H3O+
В этом случае, хлорид аммония гидролизуется, образуя аммиак (NH3) и гидроний-ион (H3O+), что приводит к образованию кислой среды.
Основной гидролиз
Основной гидролиз наблюдается при гидролизе солей слабых кислот и сильных оснований. В результате гидролиза образуются основания. Примером такой соли является ацетат натрия (CH3COONa):
CH3COONa + H2O → CH3COO- + Na+ → CH3COOH + OH-
Здесь ацетат натрия гидролизуется, образуя уксусную кислоту (CH3COOH) и гидроксид-ион (OH-), что приводит к образованию щелочной среды.
Смешанный гидролиз
Смешанный гидролиз происходит, когда соли слабых кислот и слабых оснований гидролизуются с образованием и кислот, и оснований. Примером такой соли является ацетат аммония (NH4CH3COO):
NH4CH3COO + H2O → NH4+ + CH3COO- → NH3 + CH3COOH
В этом случае, ацетат аммония гидролизуется, образуя аммиак (NH3) и уксусную кислоту (CH3COOH). В зависимости от соотношения концентраций образующихся кислот и оснований, среда может быть слабокислой, слабощелочной или нейтральной.
Понимание классификации гидролиза солей важно для контроля кислотности растворов в химии, промышленности и окружающей среде. Различные виды гидролиза солей используются в широком спектре приложений, таких как:
- Обработка воды: гидролиз солей может быть использован для нейтрализации кислотности или щелочности воды, что важно для очистки питьевой воды и обработки сточных вод.
- Анализ химических реакций: знание типа гидролиза солей помогает предсказать изменения в кислотности среды при проведении химических реакций, что важно для контроля и оптимизации процессов в промышленности и научных исследованиях.
- Сельское хозяйство: важно контролировать кислотность почвы для обеспечения оптимальных условий для роста растений. Гидролиз солей может быть использован для корректировки кислотности почвы путем добавления соответствующих солей.
- Фармацевтика и косметика: гидролиз солей используется для получения активных ингредиентов и регуляторов кислотности в различных продуктах, таких как лекарства и косметические средства.
Знание классификации гидролиза солей и факторов, влияющих на данный процесс, позволяет эффективно регулировать химические свойства растворов и создавать оптимальные условия для различных промышленных и научных приложений.
Примеры гидролиза солей
Гидролиз солей – это процесс разложения соли на ионы в водной среде, в результате чего образуются кислоты и основания. Рассмотрим примеры гидролиза солей различных типов металлов:
Гидролиз солей кислых металлов
Кислые металлы, такие как алюминий (Al), образуют соли, которые могут гидролизоваться с образованием кислот. Примером такой соли является сульфат алюминия (Al2(SO4)3):
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 3H2SO4
В данном случае сульфат алюминия гидролизуется с образованием гидроксида алюминия (Al(OH)3) и серной кислоты (H2SO4).
Гидролиз солей щелочных металлов
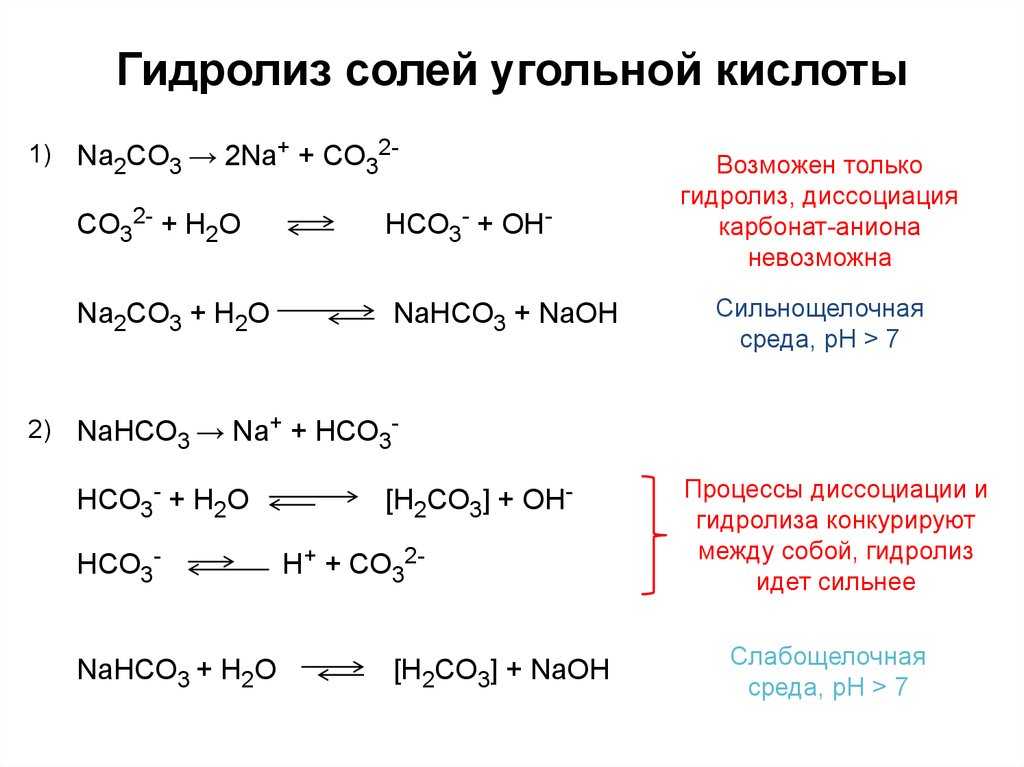
Щелочные металлы, такие как натрий (Na) и калий (K), образуют соли, которые гидролизуются с образованием оснований. Примером такой соли является карбонат натрия (Na2CO3):
Na2CO3 + H2O → 2NaOH + CO2
Здесь карбонат натрия гидролизуется с образованием щелочи – гидроксида натрия (NaOH) и углекислого газа (CO2).
Гидролиз солей амфотерных металлов
Амфотерные металлы, такие как цинк (Zn) и свинец (Pb), могут образовывать соли, которые гидролизуются как в кислотной, так и в основной среде. Рассмотрим гидролиз соли цинка – хлорид цинка (ZnCl2):
- В кислотной среде: ZnCl2 + 2H2O → Zn(OH)2 + 2HCl
В данном случае хлорид цинка гидролизуется с образованием гидроксида цинка (Zn(OH)2) и соляной кислоты (HCl).
- В основной среде: ZnCl2 + 4OH- → Zn(OH)4^2- + 2Cl-
Здесь хлорид цинка гидролизуется с образованием тетрагидроксоцинката-иона (Zn(OH)4^2-) и хлорид-иона (Cl-).
Эти примеры гидролиза солей иллюстрируют разнообразие химических реакций, происходящих в различных средах. Понимание механизма гидролиза и его связь с типом металла в солях имеет значительное практическое значение в химии, промышленности и окружающей среде.
Применение знаний о гидролизе солей включает в себя:
- Регулирование кислотности растворов: в химии и промышленности гидролиз солей используется для контроля кислотности и щелочности растворов, что важно для поддержания оптимальных условий химических реакций.
- Очистка воды: в технологии очистки воды гидролиз солей применяется для удаления загрязнителей и нейтрализации нежелательных ионов, что способствует улучшению качества воды.
- Сельское хозяйство: гидролиз солей используется для корректировки кислотности почвы, что важно для роста и развития растений.
- Фармацевтика и косметика: гидролиз солей позволяет получать активные ингредиенты и регуляторы кислотности для различных продуктов, таких как лекарства и косметические средства.
Осведомленность о гидролизе солей и его классификации позволяет специалистам и исследователям эффективно использовать этот процесс для достижения оптимальных результатов в промышленности, науке и сельском хозяйстве.
Практическое применение гидролиза солей
Гидролиз солей играет важную роль в различных отраслях науки и промышленности. Рассмотрим примеры практического применения гидролиза солей в производстве, аналитической химии и медицине.
В производстве
- Химическая промышленность: гидролиз солей используется для получения важных химических соединений, таких как щелочи и кислоты, которые используются в различных процессах, включая производство мыла, стекла и текстильных волокон.
- Очистка воды: гидролиз солей применяется для регулирования кислотности воды и удаления загрязнителей, что обеспечивает безопасное и чистое питьевое водоснабжение.
- Сельское хозяйство: гидролиз солей используется для корректировки кислотности почвы, что важно для роста и развития растений.
В аналитической химии
- Титрование: гидролиз солей является ключевым механизмом в методе титрования, используемом для определения концентрации кислот и оснований в растворах.
- Хроматография: гидролиз солей влияет на процесс хроматографии, который применяется для разделения и анализа химических компонентов смесей.
В медицине
- Фармацевтика: гидролиз солей используется для получения активных ингредиентов и регуляторов кислотности в лекарственных препаратах.
- Диализ: гидролиз солей играет роль в процессе диализа, который используется для очистки крови пациентов с почечной недостаточностью. Гидролиз солей помогает в регулировании электролитного баланса и кислотности крови.
- Инфузионные растворы: гидролиз солей имеет значение в создании инфузионных растворов, таких как физиологический раствор, который используется для гидратации, замены потерь электролитов и стабилизации кислотно-основного баланса пациентов.Гидролиз солей играет важную роль в широком спектре практических применений в производстве, аналитической химии и медицине. Знание основ гидролиза солей и его влияния на различные процессы позволяет специалистам эффективно управлять и оптимизировать химические реакции, процессы очистки воды и лечение пациентов.
Учитывая все вышеизложенное, гидролиз солей является важным аспектом в различных областях промышленности и науки. Он помогает в решении сложных проблем, связанных с водоочисткой, контролем качества в химической промышленности, а также